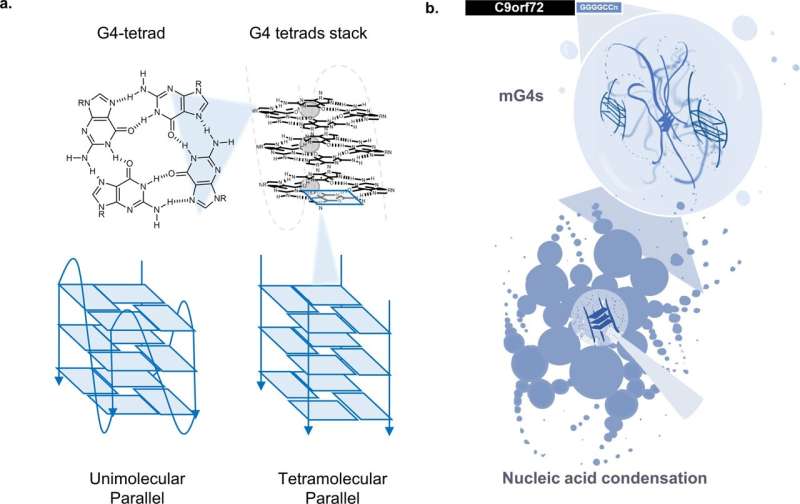
ویژگی های ساختاری و فرضیه مکانیکی G-چهارگانه. آ ویژگی های ساختاری G-quaduplexes – داربست G4 از یک G-tetrad تشکیل شده است، یک مجموعه چهارپاره مسطح از پایه های گوانین (G) که توسط Hoogsteen H-bonding به هم متصل شده اند. G4-tetrads برای تشکیل یک ساختار G4 معمولی که توسط کاتیون های تک ظرفیتی تثبیت می شود، پشته می شوند. که می تواند G-tetrad را که به اندازه کاتیون وابسته است هماهنگ کند (Li+» اون+> ک+). ب مکانیسم پیشنهادی تجمع در تودههای پاتولوژیک ALS/FTD – (GGGGCC)n توالی تکرار می تواند در غیاب پروتئین به دلیل تشکیل G4s چند مولکولی (mG4s) تجمع یابد. اعتبار: ارتباطات طبیعت (2023). DOI: 10.1038/s41467-023-43872-1
مطالعه اشکال عجیب و غریب RNA مرتبط با تشکیل تودهها در مغز بیماران ALS میتواند به راههای جدیدی برای درمان منجر شود.
اسکلروز جانبی آمیوتروفیک (ALS) یک بیماری پیشرونده نورون حرکتی است که باعث تخریب سلول های عصبی در نخاع و مغز می شود. بیماری های عصبی، از جمله ALS، زوال عقل و آلزایمر، علت اصلی مرگ و میر در بریتانیا هستند و هیچ درمان شناخته شده ای وجود ندارد.
علاوه بر علائم فیزیکی، یکی از مشخصههای مولکولی این بیماریها، تشکیل تودههای جامد در مغز مبتلایان است که تصور میشود عمدتاً توسط پروتئینهای خاصی هدایت میشوند. چندین دارو برای جدا کردن این تودههای پروتئینی طراحی شدهاند، اما هیچیک تاکنون به بهبود قابل توجهی در علائم دست نیافتهاند.
اکنون، تیمی به رهبری دکتر مارکو دی آنتونیو در امپریال کالج لندن، با همکاری دکتر لورنزو دی میشل (دانشگاه کمبریج) و پروفسور ریکی پاتانی (موسسه فرانسیس کریک و موسسه نورولوژی کوئین اسکوئر UCL) به این موضوع پرداخته اند. یک مکانیسم جایگزین که می تواند منجر به تشکیل تجمع در ALS شود و دریافت که اشکال غیرعادی RNA ممکن است نقش کلیدی در ساخت آنها ایفا کند.
این یافته ها می تواند به داروهای جدیدی منجر شود که این ساختارهای RNA را هدف قرار می دهند و به پتانسیل جستجو برای عوامل مشابه در بیماری های عصبی مرتبط اشاره می کند. این تحقیق در منتشر شده است ارتباطات طبیعت.
اولین نویسنده فدریکا راگوزو، که این تحقیق را برای دکترای خود انجام داد. در دپارتمان شیمی امپریال، گفت: “بیش از 20 سال است که ما به تجمعات پروتئینی به عنوان علت بیماری های عصبی نگاه می کنیم، اما عملکرد ضعیف بسیاری از داروهای کاندید نشان می دهد که ممکن است چیزی را از دست بدهیم: اینکه دانه ها ممکن است یک علامت باشند. ، به جای یک علت.
“نگاه به علل تجمعات ممکن است ما را به دلایل خود علائم هدایت کند، که می تواند به ما کمک کند راه های جدیدی برای مقابله با این بیماری های ناتوان کننده پیدا کنیم.”
RNA چهار رشته ای
محققان امپریالیستی اخیرا پروتئین انسانی را کشف کرده اند که می تواند باعث تشکیل ساختار خاصی از DNA به نام چند مولکولی G-quadruplex (mG4) شود که به جای دو رشته معمولی از چهار رشته DNA مجزا ساخته شده است. این ساختارها می توانند بخش های دوردست رشته های DNA را به هم متصل کنند، که تصور می شود به متراکم شدن DNA در هسته سلول های ما کمک می کند.
این تیم اکنون به تراکم RNA به جای DNA در ژن C9orf72 که در برخی موارد ALS جهش یافته و به شدت گسترش یافته است، بررسی کرده است. این ژن حاوی یک “تکرار انبساط” است – یک بخش تکرار شونده در DNA که با خواندن DNA به RNA تبدیل می شود.
با مطالعه رفتار RNA C9orf72، این تیم کشف کردند که بسط های RNA مرتبط با ALS می توانند mG4s تولید کنند و شبکه ای را تشکیل دهند که منجر به دانه های جامد می شود. این ساختارهای mG4 می توانند در غیاب پروتئین جمع شوند و به طور بالقوه پایه ای برای تجمع پروتئین ها در اطراف ایجاد کنند.
برای آزمایش این، تیم نشان داد که چگونه پروتئینها در حضور شبکههای mG4 تجمع مییابند و توقف تشکیل mG4 از تراکم RNA و تجمع پروتئینها جلوگیری میکند.
یک مکان جدید برای نگاه کردن
این آزمایشها با مولکولها در آزمایشگاه انجام شد، بنابراین برای بررسی اینکه آیا این احتمال وجود دارد که در افراد نیز صادق باشد، تیم سپس به دنبال تجمع mG4 در نورونهای حرکتی نخاعی بیماران ALS بودند. همانطور که انتظار میرفت، آزمایشها تجمع G4s را در تودهها در نورونهای حرکتی نخاعی مشتق شده از بیمار نشان دادند، نوعی سلول که عمدتاً در بیماری تحت تأثیر قرار میگیرد.
تیم بعدی میخواهد ارتباط بین mG4s و تودههای پروتئین را در موقعیتهای پیچیدهتر دنیای واقعی بررسی کند تا ببیند آیا محیط سلولی تأثیری دارد یا خیر، و آیا مسیرهای مناسبی برای مسدود کردن تجمع mG4 در این شرایط وجود دارد یا خیر.
دکتر مارکو دی آنتونیو، محقق ارشد، از دپارتمان شیمی امپریال، گفت: «آنچه که ما پیدا کردیم پاسخ قطعی به این معما نیست، اما نشان دادهایم که این ساختارهای غیرعادی RNA احتمالاً در تشکیل تودهها در ALS نقش دارند. این یک مسیر جایگزین برای تشکیل سنگدانه ارائه می دهد که باید در سایر بیماری های عصبی نیز مورد بررسی قرار گیرد.
درمانهای جدید برای این بیماریها به شدت مورد نیاز است و داروهای مبتنی بر اختلال در تجمع mG4s و دیگر ساختارهای غیرعادی RNA میتوانند نقش کلیدی در آینده داشته باشند.
اطلاعات بیشتر:
فدریکا راگوسئو و همکاران، انبساط مکرر هگزانوکلئوتیدی C9orf72 مرتبط با ALS/FTD، تراکم RNA را از طریق G-quaduplexes چند مولکولی تشکیل می دهد. ارتباطات طبیعت (2023). DOI: 10.1038/s41467-023-43872-1
ارائه شده توسط امپریال کالج لندن
نقل قول: ساختارهای غیرمعمول RNA می توانند اهدافی برای درمان های جدید ALS باشند (2023، 18 دسامبر) در 18 دسامبر 2023 از https://medicalxpress.com/news/2023-12-unusual-rna-als-treatments.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.